

Journal of Tropical Oceanography >
Dynamic analysis of particle-adsorbed oxylipins in typical coastal diatoms and their application in bloom monitoring*
Copy editor: LIN Qiang
Received date: 2024-10-12
Revised date: 2024-11-13
Online published: 2024-11-13
Supported by
Guangdong Basic and Applied Basic Research Foundation(2022B1515120030)
Guangdong Basic and Applied Basic Research Foundation(2022A1515010588)
Guangdong Basic and Applied Basic Research Foundation(2024A1515010938)
National Natural Science Foundation of China(42276162)
National Natural Science Foundation of China(42276130)
National Natural Science Foundation of China(41706181)
Diatom oxylipins, as key infochemicals, play a significant role in driving biological interactions during coastal diatom blooms and may influence biogeochemical cycles throughout the bloom's life cycle. Oxylipins exist in three forms in water, with particle-adsorbed oxylipins in the phycosphere reaching micromolar concentrations, making them particularly impactful in ecological contexts. In this study, we focused on polyunsaturated aldehydes (PUAs), a crucial class of oxylipins, and developed a method for rapidly quantifying particle-adsorbed PUAs during diatom growth. The method involves measuring diatom particle volumes through settling and centrifugation, and simulating the natural processes of settling and sedimentation. We observed that particle volumes varied between 12%~49%. To avoid the production of new PUAs, we optimized a derivatization process using 5% sulfuric acid-dissolved 2, 4-dinitrophenylhydrazine (DNPH), replacing the traditional neutral buffer. Using ultra-high-performance liquid chromatography (UHPLC) paired with multiple reaction monitoring (MRM) in tandem mass spectrometry, we were able to achieve rapid separation and accurate quantification of PUAs within just 5 minutes. This method was applied to monitor the growth stages of three typical red tide diatom strains in the laboratory, preliminarily exploring dynamic patterns in particle-adsorbed and related PUAs throughout the diatom growth process. Our results revealed that the particle-adsorbed PUAs concentrations in all three strains reached micromolar levels, ranging from 0.4~69 μmol·L-1. Notably, Skeletonema costatum exhibited similar trends between particle-adsorbed and particulate PUAs, with concentrations staying at a low level in the exponential phase before rising significantly during the stationary phase. In contrast, Thalassiosira rotula showed a decline in particle-adsorbed PUAs concentrations during the stationary phase compared to the exponential phase. Additionally, the composition of particle-adsorbed PUAs varied, with S. costatum being dominated by heptadienal in the exponential phase. This study provides important insights for the in situ monitoring application of diatom oxylipins during blooms and their potential ecological and biogeochemical impacts.
YANG Yang , WU Zhengchao , CHENG Yuanyue , WU Meilin , LI Qian . Dynamic analysis of particle-adsorbed oxylipins in typical coastal diatoms and their application in bloom monitoring*[J]. Journal of Tropical Oceanography, 2025 , 44(3) : 179 -187 . DOI: 10.11978/2024190
表1 苯甲醛(内标)、多不饱和醛及其衍生物在UHPLC-MS/MS负离子化模式下的MRM参数Tab. 1 MRM parameters of benzaldehyde (internal standard), PUAs and their derivatives under the negative ionization mode in UHPLC-MS/MS |
| 化合物 | 简写 | 醛类化学结构(衍生前) | 衍生物母离子 (一级质谱MS1) | 衍生物碎片离子对 (二级质谱MS2) | 锥孔电压/V | 碰撞能/V |
|---|---|---|---|---|---|---|
| 苯甲醛(内标) | Ben |  | 284.8 | 162.9 | 80 | 15 |
| 238.0 | 80 | 15 | ||||
| 庚二烯醛 | C7 | 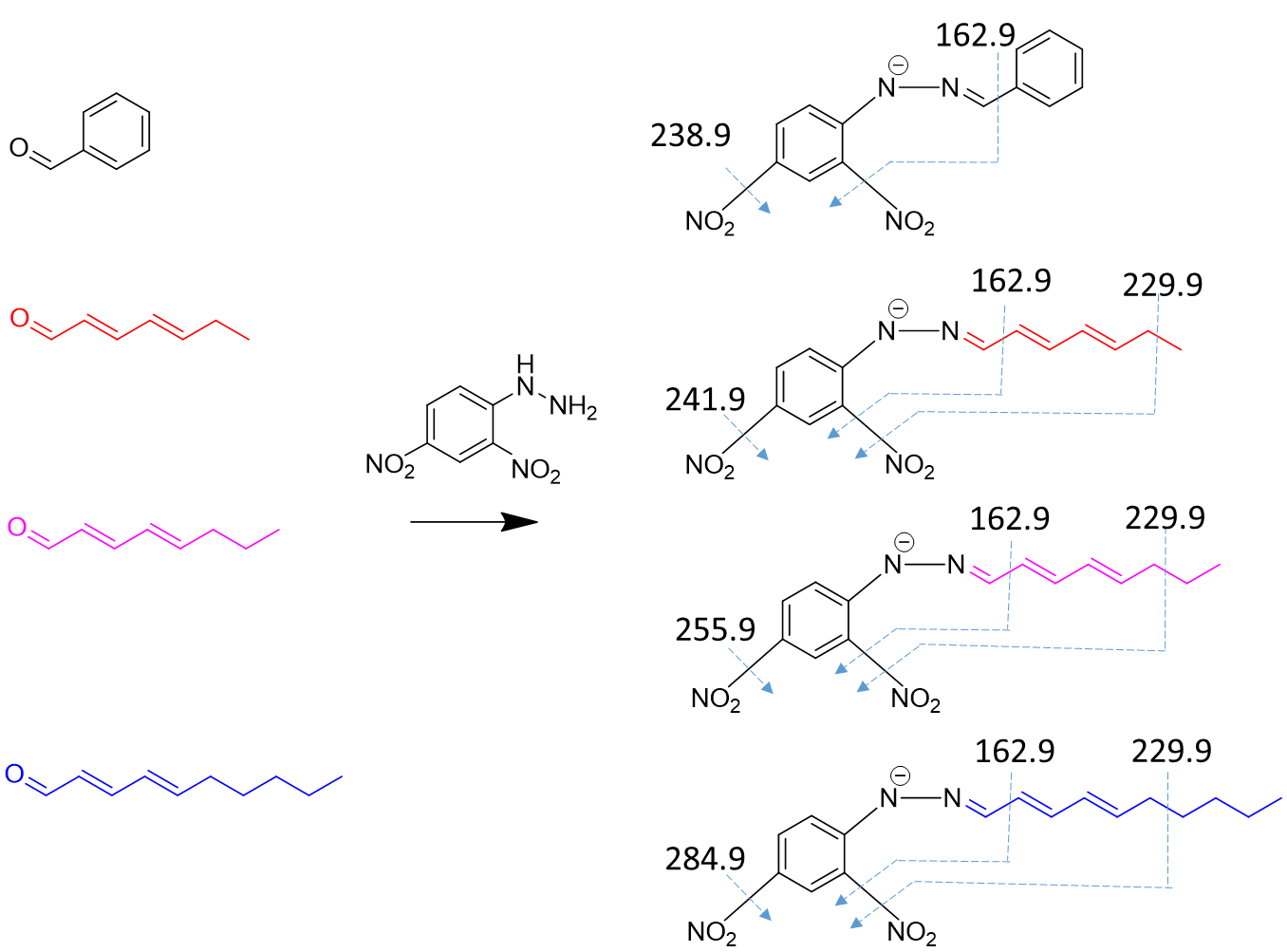 | 288.9 | 162.9 | 80 | 15 |
| 229.9 | 80 | 15 | ||||
| 241.9 | 80 | 15 | ||||
| 辛二烯醛 | C8 | 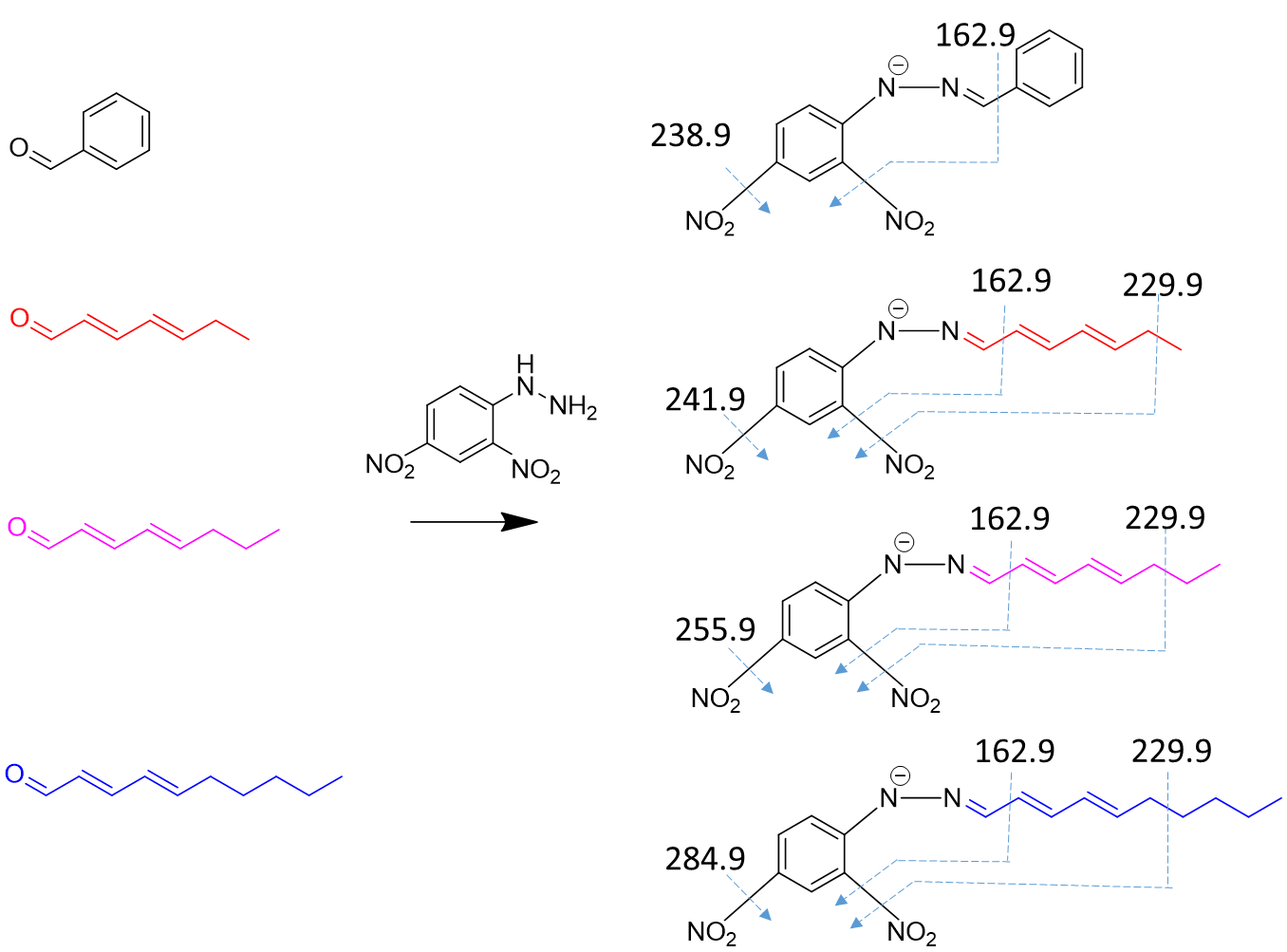 | 302.8 | 162.9 | 80 | 15 |
| 229.9 | 80 | 15 | ||||
| 255.9 | 80 | 15 | ||||
| 葵二烯醛 | C10 |  | 330.9 | 162.9 | 80 | 15 |
| 229.9 | 80 | 15 | ||||
| 284.9 | 80 | 15 |
| [1] |
陈楠生, 张梦佳, 2021. 中国海洋浮游植物和赤潮物种的生物多样性研究进展(三): 南海[J]. 海洋与湖沼, 52(2): 385-435.
|
| [2] |
葛在名, 吴正超, 刘子嘉, 等, 2020. 去吸附法测定珠江口颗粒附着细菌的丰度特征及其环境因子耦合研究[J]. 海洋环境科学, 39(4): 505-510.
|
| [3] |
黄邦钦, 肖武鹏, 柳欣, 2021. 中国边缘海浮游植物群落时空格局与演变趋势[J]. 厦门大学学报(自然科学版), 60(2): 390-397.
|
| [4] |
时免免, 赵艺, 常原恺, 等, 2023. 氧脂素信号调控气孔运动的研究进展[J]. 植物生理学报, 59(11): 1987-1997.
|
| [5] |
王慧, 蔡润林, 甘永亮, 等, 2022. 海洋浮游植物和藻际细菌的相互作用关系及其在海洋生态系统中的重要作用[J]. 汕头大学学报(自然科学版), 37(3): 3-21.
|
| [6] |
张增虎, 唐丽丽, 张永雨, 2018. 海洋中藻菌相互关系及其生态功能[J]. 微生物学通报, 45(9): 2043-2053.
|
| [7] |
郑承志, 左丽明, 马旺, 等, 2021. 不同温度下抑食抑食金球藻、中肋骨条藻和海洋卡盾藻间的相互作用[J]. 热带海洋学报, 40: 124-31.
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
/
| 〈 |
|
〉 |