

Journal of Tropical Oceanography >
A study on the community structure of macrobenthos during the period of artificial mangrove restoration in Mangzhou wetland of Hengqin Island, Zhuhai
Received date: 2016-09-25
Request revised date: 2016-12-29
Online published: 2017-06-01
Supported by
Science and Technology Project of Guangdong Province (2009B030600006)
National Science and Technology Support Program Sub-topics (2009BADB280401-02)
Science and Technology Project of Zhuhai City (PC20081050)
Copyright
The community structure and diversity of macrobenthos under different anthropogenic disturbances and different vegetation types in Mangzhou wetland of HengqinIsland, Zhuhai were investigated. A total harvest of macrobenthos were 66 species, including 20 species of mollusks, 15 species of crustaceans, 14 species of fish, nine species of annelids and eight other species (mainly insect larvae). The results showed that the major macrobenthos life form was of infaunal and adhering type while caving type (crabs) was the minor life form. Ddominance and dominant species were concentrated in a few r-strategists, such as Tarebia granifera, Cipangopaludina ussuriensis, Discapseudes mackie, Exopalaemon carinicauda and Ilyrplax deschampsi. The maximum habitat density and biomass were molluscs in each study area. Macrobenthos types mainly included smaller and shorter life cycle of r-strategist; and there was a lack of large and longer life k-strategist, which was the common feature of the early successional communities. Shannon-Wiener diversity index (H'), Pielou evenness index (J'), Margalef richness index (d), and Simpson index (C) were not significant (P>0.05) in different seasons and different areas. In three regions, the highest concentration (C = 0.4896), the lowest species diversity (H' = 1.288), the highest species richness (d = 4.301), and the lowest evenness (J' = 0.3583) were found in the river natural forests (Zone B). The species diversity, richness and evenness in artificial recovery areas were greater than those in the river natural forest areas, which indicated that the mangrove vegetation in the early development was beneficial to the habitat complexity in mudflat ecosystem as well as to the diversity of benthic fauna. Moreover, the low macrobenthos diversity, evenness and richness demonstrated that the entire system was in the early stages of biological succession.
Key words: macrobenthos; community structure; Mangzhou wetland; Zhuhai
LUO Zhangfeng , FANG Zhanqiang . A study on the community structure of macrobenthos during the period of artificial mangrove restoration in Mangzhou wetland of Hengqin Island, Zhuhai[J]. Journal of Tropical Oceanography, 2017 , 36(3) : 61 -72 . DOI: 10.11978/2016088
Fig. 1 Map of the study area, showing the sampling sites in the Mangzhou wetland of Zhuhai图1 珠海芒洲湿地采样点设置(a)和放大图(b)^A1: 裸滩; A2: 无瓣海桑; A3: 秋茄; A4: 秋茄; A5: 桐花+芦苇; A1°: 裸滩; A2°: 秋茄; A3°: 秋茄+芦苇; A4°: 芦苇; B1: 裸滩; B2: 水黄皮; B3: 短叶茳芏; B4: 芦苇 |

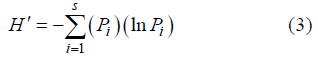
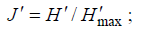


Tab. 1 Composition and distribution of species and functional feeding groups of macrobenthos in Mangzhou wetland表1 各样点大型底栖动物物种及功能群的组成与分布 |
| 物种 | 采样站点 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| A1 | A2 | A3 | A4 | A5 | A1' | A2' | A3' | A4' | B1 | B2 | B3 | B4 | |
| 青纵沟纽虫Lineus fuscovirids | + | + | + | ||||||||||
| 疣吻沙蚕 Tylorrhynchus heterochaetus | + | + | + | + | + | + | + | + | + | + | + | + | |
| 羽须鳃沙蚕Dendronereis pinnaticirrus | + | + | + | + | + | + | + | + | + | + | + | ||
| 单叶沙蚕Namalycastis abiuma | + | + | + | + | + | + | + | ||||||
| 日本刺沙蚕Neanthes japonica | + | + | + | + | + | + | |||||||
| 沙蚕 Nereis virens | + | + | + | + | |||||||||
| 双齿围沙蚕Pernereis aibuhitensis | + | + | |||||||||||
| 长吻沙蚕 Glycera chirori | + | + | + | + | |||||||||
| 孔雀缨鳃虫 Sabella pavonina | + | + | |||||||||||
| 小头虫 Capitella capitata | + | + | |||||||||||
| 瘤蜷 Tarebia granifera | + | ++ | + | + | +++ | ++ | ++ | ++ | + | + | + | + | |
| 塔蜷Thiara scabra scabra | + | + | + | + | + | + | + | + | + | ||||
| 流纹蜷 Thiara riqueti | + | + | + | + | + | ||||||||
| 瘤拟黑螺 Melanoides tuberculatus | + | + | + | + | + | + | + | + | + | + | + | + | |
| 乌苏里圆田螺Cipangopaludina ussuriensis | + | + | + | + | + | + | ++ | ++ | +++ | ||||
| 铜锈环棱螺Bellamya aeroginosa | + | ||||||||||||
| 紫游螺 Neritina[Dostia]violacea | + | + | + | ||||||||||
| 斑马游螺 Neritina (Vittina) zebra | + | ||||||||||||
| 微黄镰玉螺 Lunatia gilva | + | + | |||||||||||
| 光滑狭口螺Stenothyra glabra | + | ||||||||||||
| 耳萝卜螺Radix auricularia | + | + | |||||||||||
| 赛氏女教士螺Pythia cecillei | + | ||||||||||||
| 彩虹明樱蛤 Moerella iridescens | + | + | + | + | + | + | + | + | |||||
| 红树蚬 Geloina erosa | + | + | + | + | + | + | + | ||||||
| 河蚬 Corbicula fluminea | + | + | + | + | + | + | + | + | + | + | |||
| 湖球蚬Sphaerium lacustre | + | + | + | + | + | + | |||||||
| 缢蛏Sinonovacula constricta | + | ||||||||||||
| 日本杓蛤 Cuspidaria japonica | + | ||||||||||||
| 翡翠贻贝 Perna viridis | ++ | + | |||||||||||
| 隆起隔贻贝Septifer excisus | + | ||||||||||||
| 麦克碟尾虫 Discapseudes mackiei | ++ | + | + | + | + | ++ | ++ | + | ++ | + | |||
| 日本拟背水虱Paranthura japonica | + | + | |||||||||||
| 中华蜾蠃蜚 Corophium sinensis | + | + | + | + | + | + | |||||||
| 蚤状钩虾 Gammarus pulex | + | + | + | + | |||||||||
| 脊尾白虾 Exopalaemon carinicauda | + | + | + | + | ++ | ++ | ++ | + | + | + | + | ||
| 日本沼虾 Macrobrachium mipponensis | + | + | + | + | + | + | |||||||
| 鼓虾Alpheus sp. | + | + | |||||||||||
| 无齿相手蟹Sesarma dehaani | + | + | + | + | + | ||||||||
| 印痕相手蟹Sesarma impressa | + | ||||||||||||
| 凹背新尖额蟹 Neorhynchoplax introversus | + | ||||||||||||
| 豆形短眼蟹 Xenophthalmus pinnotheroides | + | ||||||||||||
| 橄榄拳蟹 Philyra olivacea | + | ||||||||||||
| 锯缘青蟹 Scylla serrata | + | ||||||||||||
| 谭氏泥蟹 Ilyrplax deschampsi | + | + | ++ | ++ | ++ | ++ | |||||||
| 弧边招潮蟹Uca arcuata | + | ||||||||||||
| 蜻蜓幼虫 Odonata larvae | + | ||||||||||||
| 蟌科幼虫 Coenagrionidae larvae | + | + | + | ||||||||||
| 蝇科幼虫 Muscidae larvae | + | ||||||||||||
| 摇蚊幼虫 Chironomid larvae | + | + | + | ||||||||||
| 四节蜉幼虫Baetis thermicus larvae | + | + | |||||||||||
| 小仰蝽Anisops sp. | + | ||||||||||||
| 划蝽Micronecta scholtzi | + | + | |||||||||||
| 食蚊鱼Gambusia affinis | + | + | + | + | |||||||||
宽鳍  Zacco platypus Zacco platypus | + | ||||||||||||
| 条纹刺鲃Puntius semifasciolatus | + | + | |||||||||||
| 鳙鱼 Hypophthalmichthys nobilis | + | + | |||||||||||
| 鲫鱼 Carassius auratus | + | ||||||||||||
| 大弹涂鱼Boleophthalmus pectinirostris | + | ||||||||||||
| 舌鰕虎鱼 Glossogobius giuris | + | + | |||||||||||
斑纹舌  虎鱼 Glossogobius olivaceus 虎鱼 Glossogobius olivaceus | + | ||||||||||||
鲻  虎鱼的一种 Mugilogobius sp. 虎鱼的一种 Mugilogobius sp. | + | ||||||||||||
红狼牙   鱼 Odontamblyopus rubicundus 鱼 Odontamblyopus rubicundus | + | + | + | + | |||||||||
少鳞  Sillago japonica Sillago japonica | + | ||||||||||||
| 尼罗罗非鱼Oreochromis nilotica | + | + | |||||||||||
| 香鱼 Plecoglossus altivelis | + | + | + | ||||||||||
| 梭鱼Liza haematocheilus | + | ||||||||||||
Fig. 2 Compostion of macrobenthos in different study areas图2 各区域大型底栖动物组成 |
Fig. 3 Life form of macrobenthos in different study areas图3 各区域大型底栖动物生活型 |
Fig. 4 Compostion of macrobenthos at different sampling sites图4 各样点大型底栖动物类群组成 |
Fig. 5 Composition of macrobenthos in different study areas and four seasons图5 各区域不同季节大型底栖动物组成 |
Tab. 2 Dominant species and dominance indices in different study areas表2 各样点优势种及优势度 |
| 优势种 | 生活型 | 优势度指数 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 恢复区 | 河道 | |||||||||||||
| A1 | A2 | A3 | A4 | A5 | A1' | A2' | A3' | A4' | B1 | B2 | B3 | B4 | ||
| 青纵沟纽虫 | GSB | 0.048 | ||||||||||||
| 疣吻沙蚕 | GSB | 0.176 | 0.040 | 0.030 | ||||||||||
| 羽须鳃沙蚕 | GSB | 0.190 | 0.020 | 0.070 | 0.067 | |||||||||
| 单叶沙蚕 | GSB | 0.048 | ||||||||||||
| 日本刺沙蚕 | GSB | 0.022 | ||||||||||||
| 瘤蜷 | GS | 0.211 | 0.601 | 0.047 | 0.034 | 0.283 | 0.868 | 0.183 | 0.126 | 0.171 | 0.051 | 0.034 | ||
| 塔蜷 | GS | 0.032 | 0.026 | |||||||||||
| 瘤拟黑螺 | GS | 0.023 | 0.021 | 0.025 | ||||||||||
| 乌苏里圆田螺 | GS | 0.025 | 0.191 | 0.362 | 0.422 | |||||||||
| 翡翠贻贝 | GSB | 0.118 | ||||||||||||
| 彩虹明樱蛤 | GSB | 0.028 | ||||||||||||
| 河蚬 | GSB | 0.021 | ||||||||||||
| 麦克蝶尾虫 | GS | 0.542 | 0.054 | 0.156 | 0.023 | 0.495 | 0.167 | |||||||
| 脊尾白虾 | GS | 0.063 | 0.020 | 0.679 | 0.127 | 0.127 | 0.028 | |||||||
| 摇蚊幼虫 | GSB | 0.023 | ||||||||||||
| 谭氏泥蟹 | GSB | 0.447 | 0.327 | 0.038 | 0.053 | |||||||||
注: 空白表示未有数据。 |
Tab. 3 Dominant species and dominance indices in different study areas表3 各区域不同季节的优势种及优势度 |
| 优势种 | 湿地 | A区 | A'区 | 河道 | |
|---|---|---|---|---|---|
| 春季 | 疣吻沙蚕 | 0.0393 | |||
| 羽须鰓沙蚕 | 0.0506 | ||||
| 瘤蜷 | 0.5365 | 0.6216 | 0.7397 | 0.0562 | |
| 河蚬 | 0.0506 | ||||
| 中华蜾蠃蜚 | 0.0281 | ||||
| 麦克蝶尾虫 | 0.0518 | ||||
| 脊尾白虾 | 0.0776 | ||||
| 谭氏泥蟹 | 0.2753 | ||||
| 夏季 | 青纵纵沟纽虫 | 0.0918 | |||
| 羽须鰓沙蚕 | 0.0253 | ||||
| 单叶沙蚕 | 0.0201 | ||||
| 瘤蜷 | 0.4928 | 0.5342 | 0.6448 | ||
| 塔蜷 | 0.0463 | ||||
| 瘤拟黑螺 | 0.0440 | 0.0540 | 0.0806 | ||
| 彩虹明樱蛤 | 0.0209 | ||||
| 翡翠贻贝 | 0.0295 | ||||
| 麦克蝶尾虫 | 0.1356 | 0.0845 | 0.1503 | 0.2463 | |
| 脊尾白虾 | 0.0800 | ||||
| 谭氏泥蟹 | 0.0649 | ||||
| 秋季 | 疣吻沙蚕 | 0.0248 | 0.3261 | ||
| 羽须鳃沙蚕 | 0.1468 | 0.0674 | |||
| 瘤蜷 | 0.1355 | 0.0954 | 0.1207 | 0.0311 | |
| 乌苏里圆田螺 | 0.3929 | 0.8128 | |||
| 麦克蝶尾虫 | 0.0550 | ||||
| 脊尾白虾 | 0.0333 | 0.0917 | |||
| 谭氏泥蟹 | 0.0224 | 0.1056 | |||
| 鳙鱼 | 0.0440 | ||||
| 冬季 | 疣吻沙蚕 | 0.0393 | |||
| 羽须鳃沙蚕 | 0.0929 | ||||
| 沙蚕 | 0.0465 | ||||
| 瘤蜷 | 0.0219 | ||||
| 乌苏里圆田螺 | 0.0598 | 0.5132 | |||
| 河蚬 | 0.0155 | ||||
| 麦克蝶尾虫 | 0.1471 | 0.1784 | |||
| 脊尾白虾 | 0.2066 | 0.5208 | |||
| 谭氏泥蟹 | 0.0272 | 0.1855 | |||
| 平背蚔 | 0.0284 | ||||
| 四季平均值 | 疣吻沙蚕 | 0.0276 | |||
| 羽须鳃沙蚕 | 0.0344 | ||||
| 瘤蜷 | 0.2037 | 0.2346 | 0.2646 | 0.0263 | |
| 乌苏里圆田螺 | 0.0813 | 0.3416 | |||
| 麦克蝶尾虫 | 0.0533 | 0.0491 | 0.0915 | ||
| 脊尾白虾 | 0.0552 | 0.1843 | |||
| 谭氏泥蟹 | 0.1089 |
Fig. 6 Density and biomass of macrobenthos in different areas图6 各区域间的栖息密度和生物量 |
Fig. 7 Densiy of macrobenthos in different study areas and seasons图7 各区域各季节大型底栖动物的栖息密度 |
Fig. 8 Biomass of macrobenthos in different study areas and seasons图8 各区域各季节大型底栖动物生物量 |
Tab. 4 Biodiversity indices at different sampling sites and in different areas表4 各样点及区域的生物多样性指数表 |
| 各样点及区域 | d | C | J' | H' |
|---|---|---|---|---|
| A1 | 2.421 | 0.1705 | 0.7798 | 2.0000 |
| A2 | 1.690 | 0.6497 | 0.3537 | 0.8790 |
| A3 | 2.711 | 0.3245 | 0.6174 | 1.7120 |
| A4 | 3.840 | 0.2519 | 0.6613 | 2.0440 |
| A5 | 3.466 | 0.2123 | 0.6922 | 2.0010 |
| A区 | 4.676 | 0.2494 | 0.5795 | 2.0600 |
| A1' | 3.172 | 0.7569 | 0.2103 | 0.6685 |
| A2' | 2.399 | 0.5211 | 0.3398 | 0.9821 |
| A3' | 2.534 | 0.3385 | 0.4907 | 1.3900 |
| A4' | 3.489 | 0.2609 | 0.5241 | 1.6870 |
| A’区 | 5.645 | 0.3293 | 0.3818 | 1.4780 |
| B1 | 4.206 | 0.2328 | 0.6681 | 2.1230 |
| B2 | 2.437 | 0.2697 | 0.6030 | 1.6720 |
| B3 | 2.679 | 0.5484 | 0.3431 | 1.0280 |
| B4 | 3.142 | 0.7200 | 0.2234 | 0.7099 |
| B区 | 4.301 | 0.4896 | 0.3593 | 1.2880 |
Fig. 9 The hierarchical cluster dendrogram (a) and non-metric multidimensional scaling ordinations (b) of macrofauna communities at different sampling sites图9 不同采样站位大型底栖动物群落结构的等级聚类分析(a)和非参数多变量标序(b) |
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
/
| 〈 |
|
〉 |